免疫组织化学(Immunohistochemistry, IHC)是一种利用抗原–抗体特异性结合原理,通过显色或荧光标记体系对组织或细胞中的特定抗原进行定位、定性和半定量分析的技术。自20世纪中叶以来,IHC技术已成为基础生物学研究与临床病理诊断的重要工具,尤其在肿瘤标志物检测、疾病分型、分子病理诊断及治疗靶点验证等方面发挥着关键作用。
IHC全流程操作视频
石蜡切片IHC-P实验操作流程
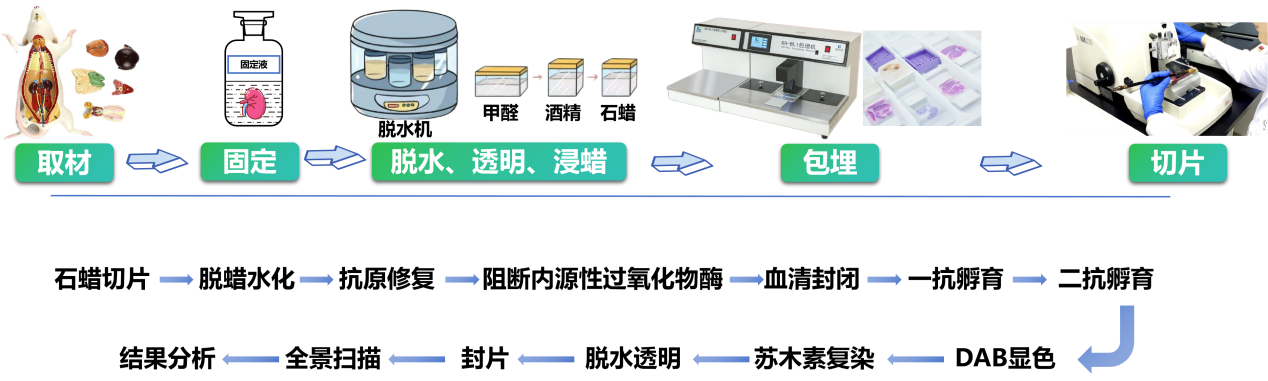
1.脱蜡至水
在对石蜡切片染色前,须进行脱蜡处理,才能使切片顺利染色。
1)二甲苯Ⅰ 10分钟;
2)二甲苯Ⅱ 10分钟;
3)二甲苯Ⅲ 10分钟;
4)无水乙醇Ⅰ 3分钟;
5)无水乙醇Ⅱ 3分钟;
6)95%酒精 3分钟;
7)流水冲洗 3分钟。
2. 抗原修复
抗原修复方式常用的有高压修复、水煮修复、酶修复;常用的修复溶液有柠檬酸溶液(pH 6.0)、EDTA溶液(pH 9.0)、Tris-EDTA(pH 9.0)、胰酶、胃蛋白酶等。
1)水煮修复:高温容器中加入适量 1×Tris-EDTA(pH9.0)/ 柠檬酸(PH6.0)缓冲液,电磁炉加热使其沸腾3-5分钟确保低火下无气泡;将组织切片放入容器内,电磁炉调至低功率维持温度在90-95℃煮20分钟,盖上锅盖。室温冷却10分钟后,流水冲洗冷却至室温。(对于骨等容易脱片的组织,可采用60℃过夜修复。)
2)高压修复:高压锅中加入适量1×柠檬酸(pH6.0)缓冲液,不加盖加热至沸腾,将组织切片放入高压锅内,加阀、加热至均匀喷气后,维持2分钟,室温冷却10分钟后,待压力阀落下打开高压锅盖,流水冲洗冷却至室温。
注:本方法适用于较难检测或核抗原的抗原修复。
3)酶修复:切片稍甩干后用滤纸将组织周围的水擦干,用组化笔在组织周围画圈(防止抗体流走,注意组化笔尖不能沾水,画的圈要大小适中,距离组织0.5cm左右),在圈内滴加胰酶工作液覆盖组织,切片平放于湿盒内室温孵育20分钟,蒸馏水浸洗3次,每次3分钟。
注:抗原修复的原因:在甲醛或多聚甲醛固定过程中,组织中部分抗原发生了蛋白之间交联及醛基的封闭作用,从而失去抗原活性。通过抗原修复,可以使得细胞内抗原决定簇重新暴露,提高抗原检测成功率。
3、免疫组织化学染色
1)纯水清洗切片三次,每次5分钟。
2)阻断:切片放入3 % 过氧化氢水溶液中,孵育10分钟。
注:阻断原因:组织中的粒细胞、单核细胞及红细胞等存在内源性过氧化物酶,这些酶和辣根过氧化物酶一样,可与显色剂DAB、AEC起反应而造成假阳性,消除内源性过氧化物酶的方法是用过氧化氢溶液阻断。
3)用纯水清洗切片两次,每次5分钟。
4)切片稍甩干后用滤纸将组织切片周围的水擦干,用组化笔在组织周围画圈,在圈内滴加1%BSA配制的10%阴性山羊血清,覆盖组织,室温封闭1h。
5)清除封闭液,然后每个切片加入用推荐的抗体稀释剂稀释的一抗(通常100μL/组织),置于湿盒室温孵育1h。
6)清除抗体溶液,用1×TBST浸洗3次,每次5分钟。
7)切片拍干后在圈内滴加羊抗兔或鼠二抗(HA1119或HA1120)覆盖组织,置于湿盒室温孵育20分钟。
*HA1119(HRP Conjugated Goat anti-Rabbit IgG UltraPolymer Goat Polyclonal Antibody)
*HA1120(HRP Conjugated Goat anti-Mouse IgG UltraPolymer Goat Polyclonal Antibody)
8)1×TBST浸洗3次,每次5分钟。
9)DAB显色:切片拍干后在圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,观察至出现阳性信号或显色5分钟,用盛有自来水的洗瓶或DAB专用烧杯冲洗玻片终止显色,自来水流水冲洗5-10分钟。
注:DAB试剂有潜在致突变作用,配制及显色时需戴双层手套防护,DAB显色后使用专用洗涤烧杯,不与其他烧杯混用。
4、复染脱水
1)苏木素 10分钟;
2)流水冲洗 3分钟;
3)促蓝 1分钟;
4)流水冲洗 3分钟;
5)95%酒精Ⅰ 1分钟;
6)95%酒精Ⅱ 1分钟;
7)95%酒精Ⅲ 1分钟;
8)无水乙醇Ⅰ 1分钟;
9)无水乙醇Ⅱ 1分钟;
10)二甲苯Ⅰ 1分钟;
11)二甲苯Ⅱ 1分钟;
12)烤箱65℃ 2分钟。
*试剂须定期更换,促蓝液变色可提前更换。
5、封片
中性树胶封固。
注:整个操作过程应保持切片处在湿润环境中,避免切片变干,否则极易产生非特异染色。

 免疫组化
免疫组化


 浙公网安备 33019202000643号
浙公网安备 33019202000643号