小鼠(大鼠)灌流固定操作
灌流固定(蠕动泵)
1. 准备蠕动泵
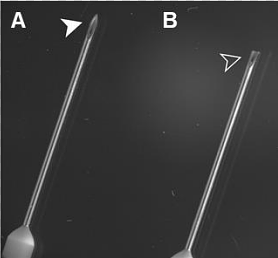
1.1 剪去静脉输液针针头部分尖端,使其略微变钝,以防进针时刺破主动脉壁(图1)。
1.2 将转接头和25#硅胶管连接并固定(此处为灌流管路中最易爆开的位置)。
1.3 设置蠕动泵流速
小鼠为12~15mL/min,大鼠为20mL/min左右。
1.4连接灌流装置和输液针
取100 mL水冲洗管道除去管内残留物,然后取两个烧杯分别盛满 PBS和固定液(冰盒预冷),将灌流管开放的末端置入PBS烧杯。开启蠕动泵,待溶液流动缓慢且稳定后关闭蠕动泵(在通风橱中进行)。
2. 准备动物
2.1 禁食
12h或过夜,不禁水。
2.2 称重
称量动物体重并记录。
2.3 麻醉
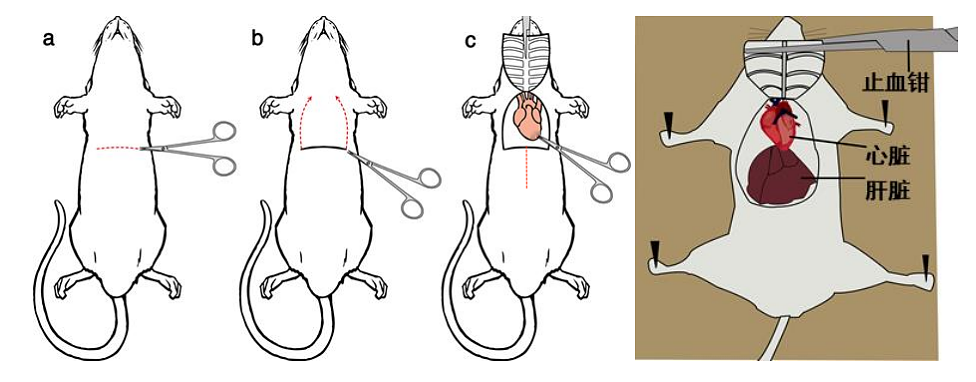
保定小鼠(或大鼠,下同),针头在下腹部腹白线的偏左或偏右位置,从下腹部朝头方向平行进针,腹腔注射麻醉剂(图2A)。(进针不需太深以避免刺入脏器,有明显穿透感但无阻碍感即可,进针后应确认回抽无血液、肠液、尿液。)

2.4 将小鼠放回笼内,等待约5分钟,小鼠心跳及呼吸均匀、肌肉松弛、四肢无活动、刺激胡须或脚趾无反应,即视为进入深度麻醉状态。若麻醉过量导致小鼠心脏停跳,应尽快开始灌流,避免凝血导致灌流不畅。
2.5 确认小鼠进入麻醉状态后,将其腹部向上摆放在泡沫板或软木材质的手术台上,四肢用胶带或针头/大头针固定(图2B、C),使其在灌流过程中无法随意移动。
3. 心脏灌流
3.1 用眼科镊拉起胸腔外侧皮毛,用解剖剪剪去皮肤,暴露白色剑突。
3.2 用眼科镊拉起剑突,用解剖剪沿剑突下方横向剪开肌肉层,暴露横膈膜,并沿腹中线剪开腹壁暴露肝脏。
3.3 用眼科剪小心剪开横膈膜,注意不要伤到上方的心脏及肺脏。
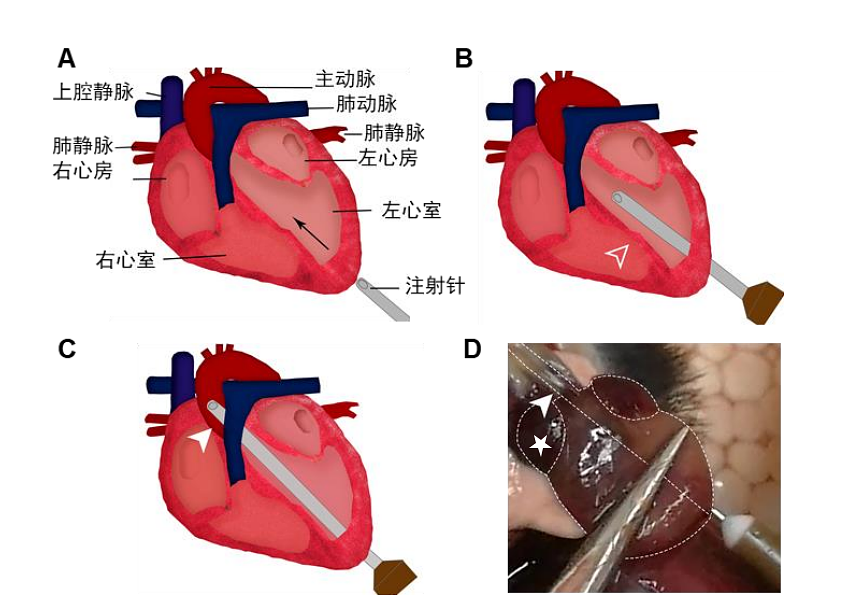
3.4 沿胸骨外侧剪开两侧肋骨,翻开胸廓前壁并用止血钳固定 (或将此部分组织完全剪除),以使心脏完全暴露,可看到颜色较深的右心室以及颜色较浅的左心室(图3)。
3.5 用眼科镊及解剖镊清理心脏周围脂肪组织,暴露升主动脉。
3.6 用眼科镊固定心脏,从左心室紧靠心尖处,以大致平行于心脏左右中线的角度刺入注射针(图4A)。由于针尖已经修钝,进针时会有一定的阻力感;成功穿透心室壁时,会有明确的穿透感。
3.7 继续沿着初始方向进针,若方向准确,将不会感到明显阻力,在针头成功进入主动脉时,可透过主动脉壁观察到针头。即刻用血管夹或止血钳固定针头(图4B-D)。
3.8 用眼科剪在右心房剪开一个小口(图4D白色五角星位置),随即可观察到深红色血液流出。
3.9 打开蠕动泵,流速先慢后快,初始转速可设为小鼠6rpm,大鼠设为12rpm,在更换为固定液之前逐渐增加至小鼠9rpm、大鼠15rpm,并保持至灌流结束。
注:可在灌流时暴露腹腔,调整肝脏及脾脏位置,提升两者及后端脏器的灌流效果。
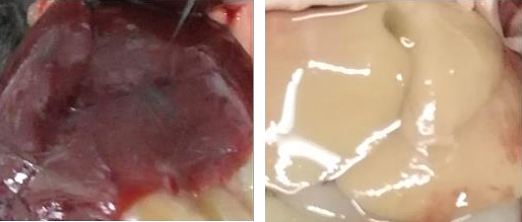
3.10 小鼠在开始灌流20s后关闭蠕动泵停止PBS灌流,迅速将灌流管末端置入装有固定液的烧杯中。确认管路无气泡引入后开启蠕动泵。大鼠在开始灌流7min后更换为固定液,也可在观察到流出液体变澄清,肝脏完全失血后停机将PBS更换为固定液(图5)。
注:一般成年小鼠PBS的灌流量约为15~20mL,大鼠为100~200mL。固定液的灌流量小鼠为20~30mL,大鼠为200~300mL。25#硅胶管内径0.48cm,每1m长的管路中溶液约为18mL。
3.11 在更换至固定液后小鼠再灌流固定2min,大鼠再灌流10min,体重在350g左右的大鼠可延长1min。在灌流固定液时可观察到肌肉收缩、胸腔上拱、尾巴翘起等现象。
4. 取组织固定
4.1 为防止取脑过程中损伤其他组织,可采用断颈取脑。
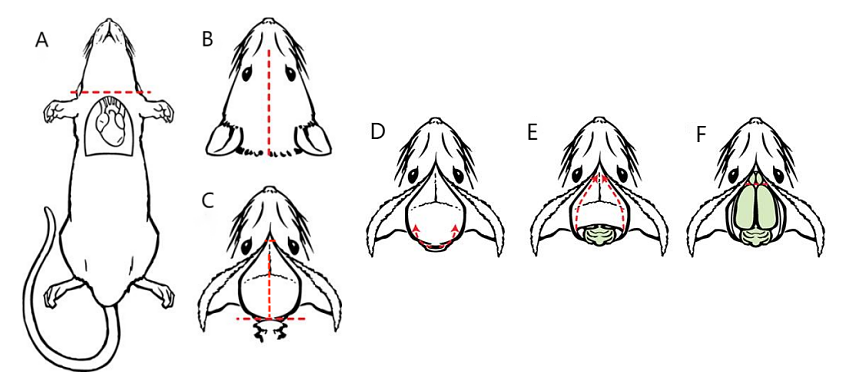
4.2 用解剖剪断颈,剪下小鼠头部,其余部位暂用湿纱布覆盖保湿。从颈部正中向鼻尖方向剪开头部上方皮毛,暴露颅骨(图6A-C)。
4.3 用解剖剪切除脑干,用眼科剪剪除颅骨周围肌肉,暴露颅骨底部枕骨。
4.4 将眼科剪单侧刀刃平行于鼠脑底部插入枕骨下方,向外分别剪断两侧颅骨。
4.5 用解剖镊小心摘除覆盖小脑的颅骨。
4.6 将眼科剪的单侧刀刃从颅骨中缝处插入,刀刃一侧朝向颅骨,避免损伤脑组织,
沿中缝剪开大脑上方至嗅球上方颅骨。直于鼠脑顶部插入中缝剪开颅骨,用解剖镊一点点小心剥离颅骨(图6C)。或者从枕骨大孔处朝向同侧眼眶方向,贴着骨头剪到眼眶处,两侧均剪开后便可用镊子小心掀去颅骨(图6D-F)。
4.7 用镊子或其他平面钝头工具从鼠脑底部平行插入到嗅球底部,切断下方神经
束,取出鼠脑。
4.8 分离摘取其他组织。
4.9 将组织放置到盛有固定液的样本瓶中,于4℃固定。固定液的量至少应为组织块总体积的10倍。
5. 肺组织灌流
上述方法正常操作时在体内的灌流通路不经过肺脏,如需获取灌流肺脏组织,可采用下列三种方法:
5.1 加大流速(仅针对小鼠):将针头保持在左心室,在上述流速的基础上逐步增大至10~12rpm,此时可观察到小鼠肺脏膨胀、由红变白,液体从鼻头流出。
5.2 右心室灌流:将针头保持在右心室稍靠上位置,按小鼠5rpm、大鼠10rpm灌流,注意不要捅破肺动脉。
5.3 小鼠肺充气与血管灌注固定:首先通过气管向肺内充气,使其扩张。针头留置右心室,剪开腹主动脉进行灌流。该方法能更准确地保留肺的解剖结构,但需要呼吸机辅助。
注:采用5.1和5.2灌流肺组织时,可能导致其他组织灌流失败;5.3仅能灌流肺脏。

 浙公网安备 33019202000643号
浙公网安备 33019202000643号